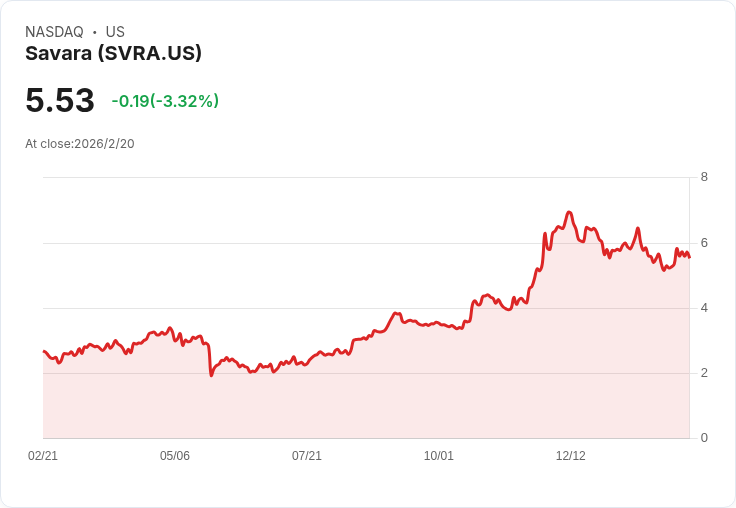
Savara的Molbreevi藥物獲得FDA優先審查,針對自體免疫性肺泡蛋白沉積症,股價上漲4.5%。
美國食品藥品監督管理局(FDA)近日宣佈將對Savara公司重新提交的Molbreevi生物製劑許可申請(BLA)進行審查。Molbreevi是一種用於治療罕見疾病自體免疫性肺泡蛋白沉積症的吸入溶液,其主要成分為重組人顆粒-巨噬細胞集落刺激因子。該藥物在接受優先審查後,預計將於8月22日作出決定。
背景方面,自體免疫性肺泡蛋白沉積症是一種影響肺部功能的罕見疾病,患者面臨呼吸困難等嚴重健康問題。Savara表示,除了美國市場外,還計劃在第一季度結束前向歐洲藥品管理局及英國醫療產品和健康護理署提交相關申請。
值得注意的是,Savara於去年12月重新提交了這項BLA,並在週五的盤後交易中,股價上漲約4.5%。分析人士指出,若Molbreevi成功上市,將為眾多患者帶來新的治療選擇,未來市場潛力不容忽視。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37