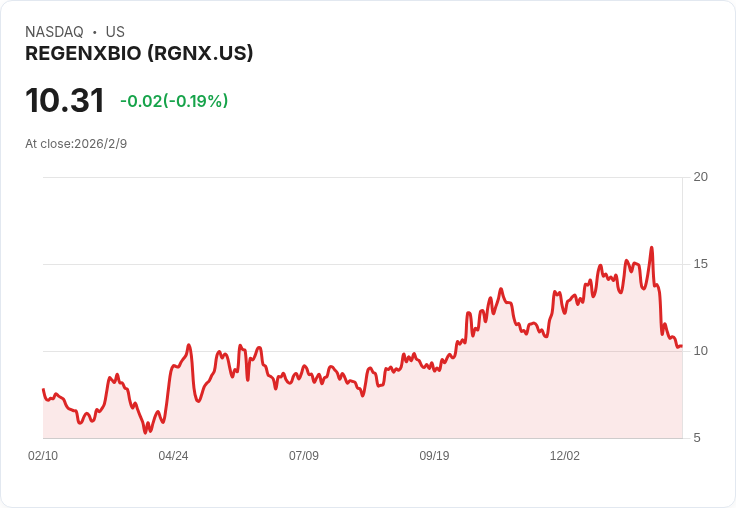
Regenxbio的基因療法RGX-121因美國FDA發出完整回應函而未獲批准,股價在盤前交易中下跌15%。公司計劃與FDA合作尋求解決方案。
Regenxbio(NASDAQ:RGNX)近日面臨重大挑戰,其基因療法候選藥物RGX-121針對罕見疾病黏多醣症II型(MPS II)的治療,遭到美國食品藥品監督管理局(FDA)拒絕。該公司收到了一封完整回應函(CRL),指出未能透過主要原因包括研究適用性標準的不確定性以及外部對照組與研究人群的可比性問題。
根據FDA的說明,CRL提及了幾個不符合批准要求的因素,例如是否能夠清楚界定神經病變患者的人群,以及CSF HS D2S6作為預測臨床效益的替代終點的合理性。此外,FDA還列出了數條潛在的後續路徑,包括展開新研究、增加患者樣本以及進行長期隨訪等,但這些措施在極為稀有的MPS II患者群體中將面臨諸多挑戰。
儘管如此,Regenxbio表示將積極與FDA溝通,以制定重提交生物製劑許可申請的計畫。此次事件突顯了在研發罕見疾病療法中的複雜性和風險,也讓投資者對公司的未來充滿疑慮。分析師認為,若無法克服當前障礙,Regenxbio可能需要重新評估其市場策略並尋找新的機會。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37