安納維克生命科學公司向歐洲藥品管理局提出請求,重啟對其阿茲海默症藥物blarcamesine的評估,以期翻轉先前的拒絕決定。
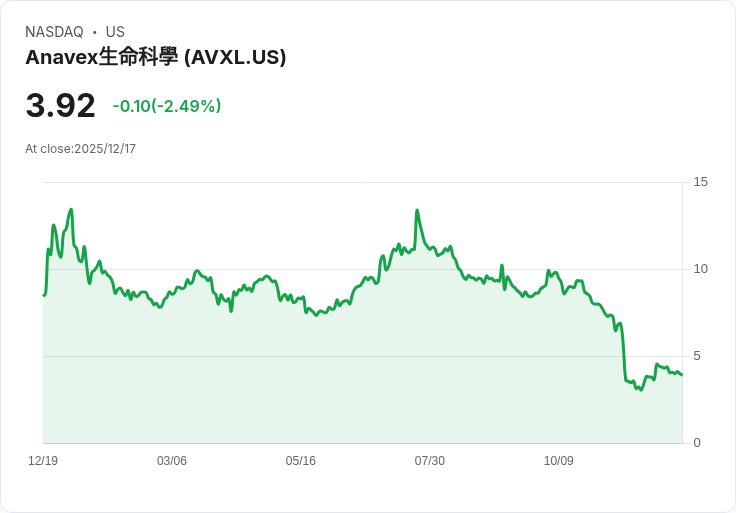
安納維克生命科學公司(Anavex Life Sciences)近日正式向歐洲藥品管理局(EMA)申請,要求重新評估該機構在去年12月對其早期阿茲海默症治療藥物blarcamesine的負面意見。此舉標誌著公司希望能夠改變先前的決策,並獲得市場授權。
根據最新消息,EMA將會進行新的評估程式,同時安納維克也提議引入一個科學諮詢小組,以提供獨立的建議和推薦。這一策略顯示出安納維克對於其產品潛力的堅信,尤其是強調blarcamesine在長期認知益處方面的可能性,儘管面臨監管挑戰。
值得注意的是,此次負面評價不僅影響了公司的未來發展,也讓許多投資者感到擔憂。然而,安納維克表示,他們將持續推動相關研究,並尋求更多的支援以促進blarcamesine的批准。在全球範圍內,隨著老年人口增長,阿茲海默症的治療需求日益迫切,這使得安納維克的努力更具重要性與緊迫感。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37