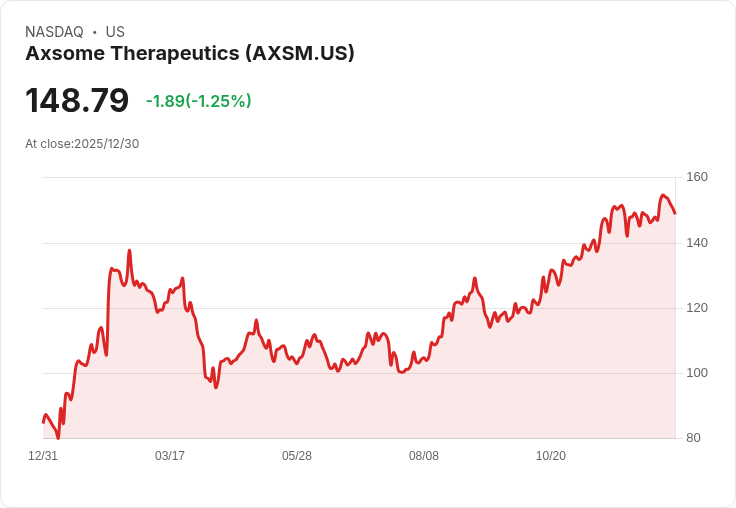
Axsome Therapeutics宣佈,其抗抑鬱藥AXS-05(Auvelity)在阿茲海默症焦慮的標籤擴充套件申請已獲得美國FDA的優先審查,目標動作日期為2026年4月30日。
Axsome Therapeutics於本週三宣佈,美國食品藥品監督管理局(FDA)已對其抗抑鬱藥AXS-05(Auvelity)的市場申請進行優先審查,旨在將該藥物的適應症擴充套件至阿茲海默症相關的焦慮症狀。根據公司宣告,此次補充新藥申請(sNDA)的目標動作日期定為2026年4月30日。
自2022年以來,AXS-05已獲得FDA批准用於成年人重度抑鬱症的治療,而早在2020年,該藥物便已獲得針對阿茲海默症焦慮的突破性療法認證,這一病症影響了多達76%的阿茲海默症患者。Axsome首席執行官Herriot Tabuteau表示:“我們非常高興FDA接受並授予我們的sNDA優先審查,我們期待與FDA繼續合作,完成後續審查。”
目前,Axsome正在積極推進其晚期研發管道,並預計AUVELITY及SYMBRAVO的市場接入會隨之擴大,顯示出公司對未來成長的信心。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37