7百萬美國阿茲海默症患者仍無法受惠於創新療法,FDA核准進度落後於歐盟,家庭壓力與治療困境加劇。
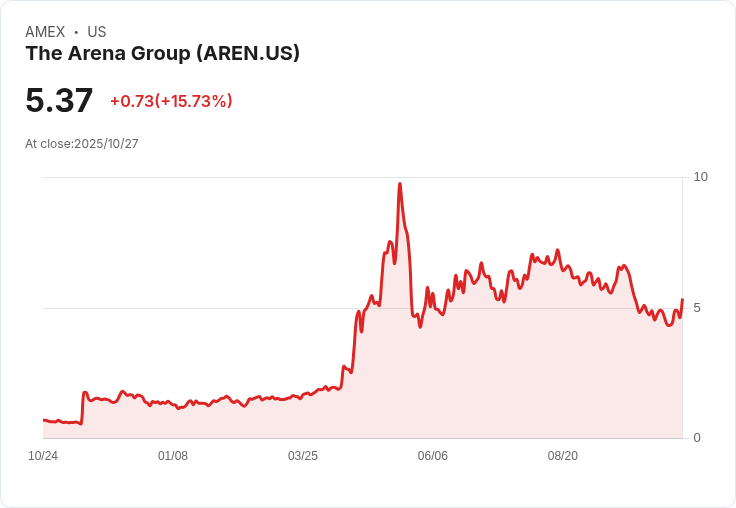
美國面臨阿茲海默症罹患率不斷攀升的嚴峻挑戰,超過7百萬患者及近1千2百萬名照護者正承受龐大精神與經濟壓力,年度醫療支出預估高達3840億美元。當全球皆在尋求突破性治療方案時,源自美國、卻率先於歐洲取得認證的Cerezen非侵入性治療裝置,成為市場矚目的新星,卻也突顯出本土患者難以受惠的現實。
Cerezen由The Arena Group(AREN)的創辦人Manoj Bhargava領銜開發,今年在歐盟通過CE認證,成為唯一獲歐洲新醫療器材規範核准的裝置型療法。臨床數據顯示,患者在六個月療程後認知分數平均提升五點,約相當於重獲一年流失的功能,更有超過七成阿茲海默症患者具資格接受此療法,相較於現有高昂且適用範圍狹窄的藥物,顯得門檻低且效果顯著。而且,裝置治療跳脫傳統「類澱粉蛋白」藥物路線,轉向恢復腦血管健康、促進腦部血流與氧氣供應,獲FDA「突破性裝置」認定並進入快速審查通道。
然而,美國食品暨藥物管理局(FDA)至今皆未正式核准Cerezen上市,造成美國創新治療反倒成為歐洲患者福利的窘境。Bhargava直言美國監管不進步令家庭失望。他語重心長指出:「我們力求美國患者優先,但現實卻讓人難以接受。」此番發言,反映出美國阿茲海默症政策慢步於患者需求之前,導致家庭自付照護成本激增,且情緒與生活負擔難以釋減。
分析指出,歐洲市場搶先核准,也意味全球治療策略正在向多元化、非藥物導向發展。業界部分專家則強調,FDA緩頰之餘須加速審查進程;亦有替代意見認為,尚需持續觀察長期安全性與效果。即便如此,Cerezen之臨床成果已為尋求改善的阿茲海默症患者點燃新希望。
展望未來,Cerezen團隊正重新與FDA積極對話,期望解開監管瓶頸、使美國家庭得以享有本土創新技術帶來的福祉。隨著歐洲即將展開療程,美國患者及政策界如何回應,將牽動全球認知障礙治療的新局勢。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37
本網站所提供資訊僅供參考,並無任何推介買賣之意,投資人應自行承擔交易風險。