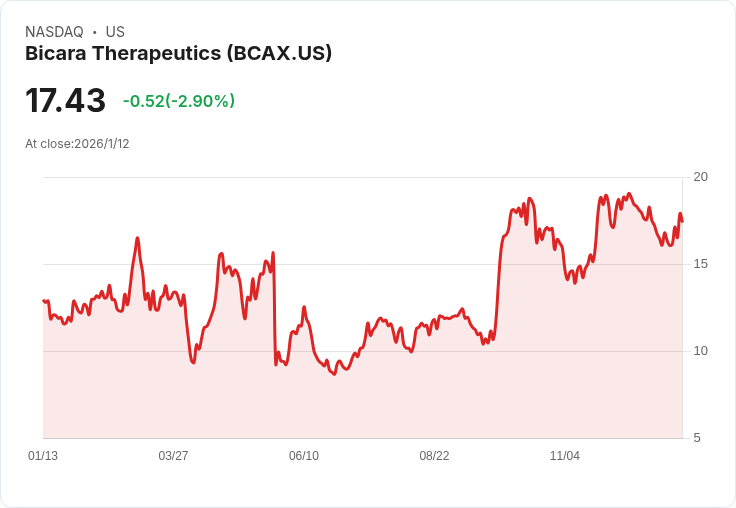
Bicara Therapeutics 選擇 1,500 mg 劑量作為 FORTIFY-HNS 第三期臨床試驗的前進劑量,並計畫在 2026 年底前完成登入。
Bicara Therapeutics 在第44屆年度J.P.摩根健康護理大會上介紹了其未來計畫,特別是針對其主導臨床專案ficerafusp alfa的發展。該公司選擇了1,500 mg劑量作為FORTIFY-HNS第三期臨床試驗的前進劑量,此決策是在第二期資料和FDA討論後做出的,旨在於2026年底前達成顯著的患者登入。這一劑量的選擇獲得FDA的支援,將加速該研究的程序,預計可望在2028年初推出。
長期跟蹤的ASCO 2025資料顯示,在HPV陰性的頭頸癌中,確認反應率高達54%(包括21%的完全反應),而且中位反應持續時間為21.7個月,中位整體生存期超過21個月,這些結果支援FDA授予其突破性療法認證。管理層表示,公司目前擁有超過4億美元的資金用以支援此重要研究,同時正在建立商業基礎設施,包括聘請首席商務官等職位。
Mazumdar指出,ficerafusp alfa被描述為“第一款也是唯一一款針對EGFR的抗體結合TGF-β配體捕捉劑”,專注於固態腫瘤的治療。她強調,HPV陰性病症佔前線復發及轉移性頭頸市場的80%至90%,且通常伴隨較差的預後及有限的治療選擇。該公司的策略是透過結合區域性TGF-β抑制與EGFR靶向,改善免疫細胞的滲透率,以增強療效和永續性。
此外,Bicara還計畫拓展ficerafusp alfa至轉移性結直腸癌和其他腫瘤群體,並預計在2026年下半年公佈早期資料。面對未來,Bicara將重點推進FORTIFY-HNS試驗,並繼續探索新的適應症,期待能夠提供更有效的治療方案。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37