Celcuity的抗乳癌藥物gedatolisib獲得FDA優先審查,預計2026年7月17日將有行動決定,為患者帶來新希望。
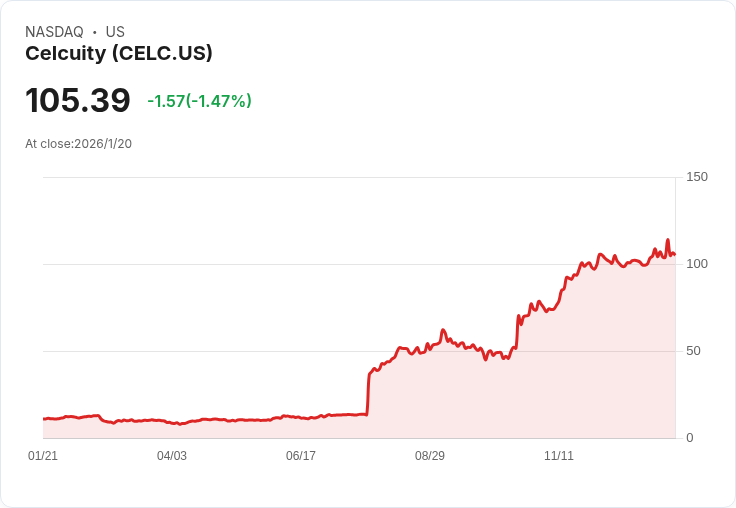
Celcuity公司於本週二宣佈,其針對特定型別乳癌的新藥gedatolisib已獲得美國食品藥品監督管理局(FDA)的優先審查。該藥物的市場申請專注於治療荷爾蒙受體陽性、HER2陰性及PIK3CA野生型的晚期乳癌,這一訊息無疑為許多患者帶來了新的希望。
根據Celcuity的說法,FDA已設定2026年7月17日作為對此新藥申請的目標決策日期。此次申請的資料來自於公司的第三階段VIKTORIA-1臨床試驗,結果顯示gedatolisib與其他療法聯合使用時,可實現高達12.4個月的中位無進展生存期,且安全性良好。
此外,Celcuity還提到,gedatolisib在未來可能創造25億至30億美元的收入潛力,隨著加速上市準備,該公司正積極推進其商業化策略。儘管面對市場競爭和不確定性,Celcuity的前景依然被看好,並將持續吸引投資者注意。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37