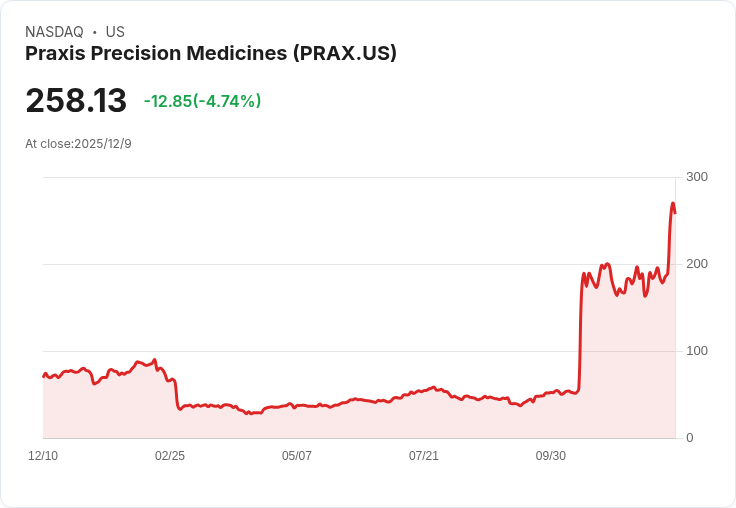
Praxis Precision Medicines宣佈,將其針對早發性癲癇腦病的elsunersen臨床試驗調整為單臂研究,以滿足FDA要求。
在近期與美國食品藥品監督管理局(FDA)進行討論後,Praxis Precision Medicines(PRAX)決定對其EMBRAVE3註冊試驗進行重大調整,將原本的雙盲安慰劑控制設計改為單臂研究,所有參與者將接受為期24週的elsunersen治療,隨後展開開放標籤延伸階段。此舉不僅簡化了研究流程,也使得參與患者數量從40人減少至30人。
Elsunersen是一種抗病毒寡核苷酸,專門用於降低SCN2A基因表達,旨在針對早期癲癇發作的根本原因。此次試驗的主要終點是評估治療前後可計數運動性癲癇發作的變化,這一指標將幫助醫學界更好地理解該藥物的效果。
儘管有些分析師認為此次修改可能反映出試驗初期面臨挑戰,但Praxis仍堅信此策略能夠加速新藥上市的步伐。未來,若elsunersen獲得批准,將可能成為癲癇治療領域的一大突破,並促進公司其他產品的研發程序。
點擊下方連結,開啟「美股K線APP」,獲得更多美股即時資訊喔!
https://www.cmoney.tw/r/56/9hlg37